IRB 소개
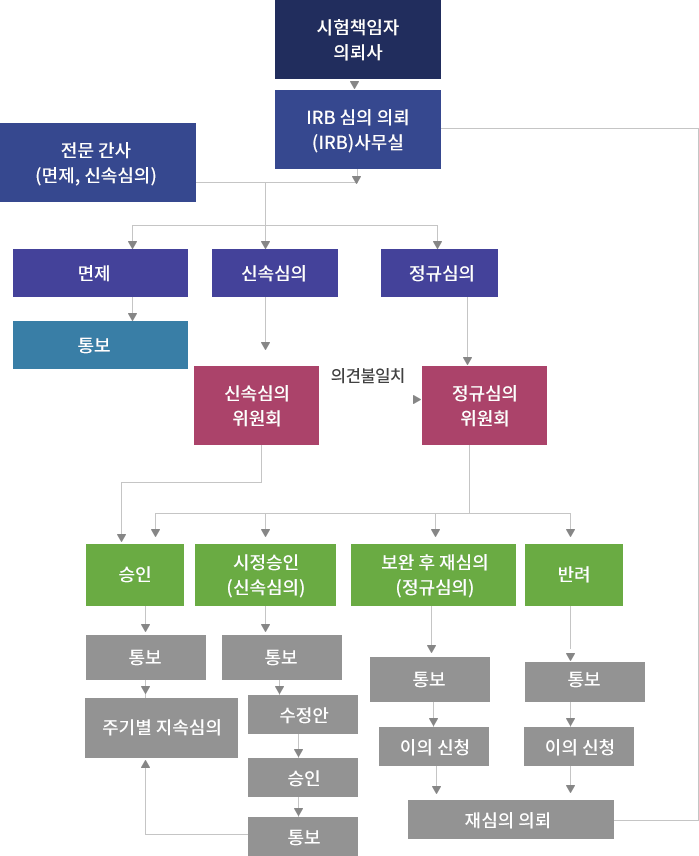
IRB 심의 개요 및 흐름도
예수병원 IRB 정보
| 담당자 | 최수경 행정간사 |
|---|---|
| 전화번호 | 063-230-8845 |
| Fax | 063-232-6321 |
| reginesu@hanmail.net | |
| 주소 | (55046)전주시 완산구 서원로 394 예수병원 3주자창 1층 기독의학연구원 IRB사무국 |
제출서류 및 일정 안내
제출부수
| 구분 | 내용 |
|---|---|
| 심사비 | 의뢰자 주도 : 70만원(VAT 10% 별도) |
| 연구자 주도 : 연구비가 있는 경우 30만원(계산서 요청시 VAT 10% 별도) | |
| PMS : 50만원(VAT 10% 별도) | |
| 지속심의 : 10만원(의뢰자 주도에 한하고 PMS제외) (VAT 10% 별도) | |
| 계좌정보 신협 / 131-003-861583(구계좌:07063-12-004320) / 예금주 : 예수병원유지재단 |
|
| 연구비 | 총 간접비는 직접비의 20%를 징수함. |
| 계좌정보 기업은행 / 304-020172-01-259 / 예금주 : 예수병원유지재단 |
|
| 문서보관료 | 최초 3년간은 무상으로 보관하고, 의뢰사에서 추가 보관을 요청하는 경우 4년부터 15년까지는 연간 20만원으로 책정하되 전체 바인더가 10개를 초과하는 경우는 연간 30만원(VAT별도). 문서이관 시 선지급을 원칙으로 함. |
| Monitor 전용 EMR ID신청 | 프로그램사용권한 요청서(연구자 작성 및 내부 결재 필요), 보안서약서(모니터 요원 작성) 작성 후 원내 연구담당자 또는 IRB사무국을 통해 전산실 접수 |
| 모니터링룸 예약 | 최수경(063-230-8845)에게 사전 예약 |
| 계약서 검토 | lhm7033@hanmail.net으로 사전 검토 요청 (담당자 : 이현미) 계약서 검토 요청 시 초기승인서와 초기심의 의뢰서, 연구비 실행 예산서를 첨부하여 검토 요청 |
| 동의서 날인 천공 필수 | 동의설명문 및 동의서(정보활용 동의서)는 필요한 부수만큼 제작하여 IRB사무실로 접수(인편 또는 우편 및 택배발송 가능) 요청 시 사무국에서 날인 후 연구자에게 전달 가능함. |
| ※ 심사비는 심의 이전 입금을 원칙으로하며 심사비 및 연구비 입금 후에는 반드시 전화 연락 요망. 계산서 요청은 이현미 선생님(063-230-8855, lhm7033@hanmail.net)에게 연락바람. |
|
제출서류
초기심의 의뢰 시 제출 서류
- ① 약사법/의료기기법 관할 하의 임상시험
ㄱ. 연구계획 심의의뢰서
ㄴ. 임상시험계획서(Protocol) 및 임상시험계획 요약
ㄷ. 연구대상자 설명문 및 동의서(Informed Consent Form)
ㄹ. 증례기록서(Case Report Form)
ㅁ. 연구대상자에게 제공되는 정보
ㅂ. 연구대상자 모집 관련 자료(공고문, 모집매체에 대한 정보)
ㅅ. 임상시험자 자료집(Investigator’s Brochure)
ㅇ. 피해자 보상규약(보험 가입증서 등)
ㅈ. 식품의약품안전처 승인서
ㅊ. 제품(수입)품목 허가증 사본
ㅋ. 연구진 이력 및 GCP교육이수증
ㅌ. 연구자 서약서,
ㅍ. 이해상충 서약서, 이해상충 신고서(해당하는 경우)
ㅎ. 연구비 실행예산서 - ② 인간대상 연구
ㄱ. 연구계획 심의의뢰서
ㄴ. 연구계획서
ㄷ. 대상자 설명문 및 동의서/대상자 동의 면제 사유서
ㄹ. 연구대상자에게 제공되는 정보(설문지 등)
ㅁ. 증례기록서
ㅂ. 연구진 이력 및 GCP교육 이수증
ㅅ. 연구자 서약서
ㅇ. 이해상충 서약서, 이해상충 신고서(해당하는 경우)
ㅈ. 연구비 실행 예산서(해당하는 경우) - ③ 인체유래물 연구
ㄱ. 연구계획 심의의뢰서
ㄴ. 연구계획서
ㄷ. 인체유래물 연구동의서(법정서식)/대상자 동의 면제 사유서(해당하는 경우)
ㄹ. 증례기록서
ㅁ. 연구진 이력 및 GCP교육이수증
ㅂ. 연구자 서약서
ㅅ. 이해상충 서약서, 이해상충 신고서(해당하는 경우)
지속심의 신청시 제출 서류
- 지속심의 신청서 양식, 최근 사용중인 동의서(대상자 모집이 완료된 경우는 제외), 변경 대비표(해당하는 경우), 등록한 대상자 명단, 취득한 동의서 사본 등
변경 신청시 제출 서류
- 계획 변경 신청서 양식, 변경 대비표, 변경된 내용(연구계획서, 증례기록서, 대상자 설명문 및 동의서, 연구비 내역서 등) 등의 해당서류
종료보고 및 결과보고시 제출 서류
- 연구 종료보고서, 결과보고서 양식, 연구 결과 또는 임상시험 성적서 등의 자료
이상반응 보고시 제출서류
- 이상반응 보고서 양식 및 근거서류(CIOMS FORM 등)
연구책임자가 자신이 이미 수행한 연구를 통해 수집된 개인정보등을 제3자에게 제공하기 위해 심의위원회에 심의를 요청하는 경우
- 연구대상자등이 개인정보 제공에 동의한 사실을 증명할 수 있는 서류, 개인정보 제공 시 개인정보보호대책에 관한 사항, 익명화 방법에 대한 자료, 제공받아 수행하려는 연구계획서에 대한 승인서(추후 제출 가능)
